Desarrollo de un medicamento
Características de las Fases de Investigación Clínica
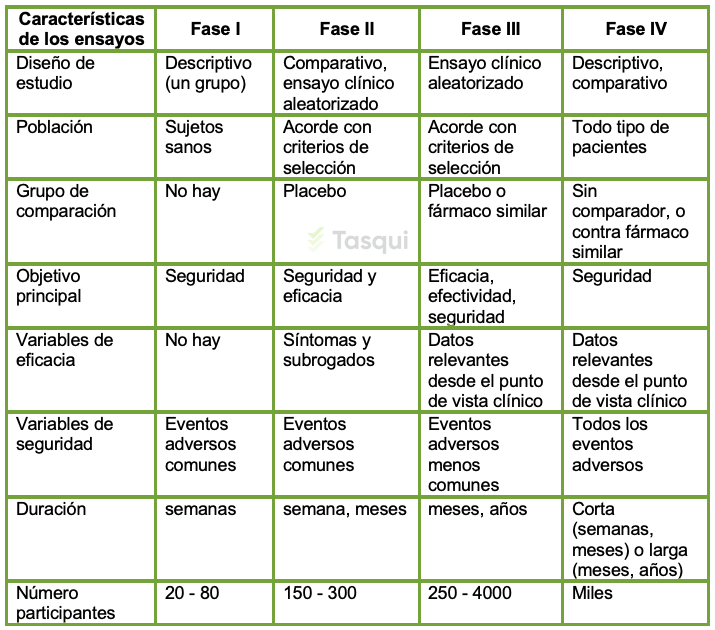
De este modo, la información sobre la seguridad y eficacia de los medicamentos generada desde los ensayos clínicos es limitada considerando el alcance (limitado) de estos estudios, los cuales incluyen una población reducida que se expone al uso del medicamento, en comparación con la población (millones) que utilizará el medicamento a lo largo de un tiempo mucho mayor que en el que se desarrollan los ensayos clínicos. Así mismo, en el desarrollo de estas investigaciones, no se incluyen segmentos de población como niños, mujeres embarazadas o ancianos, los cuales inevitablemente utilizarán los medicamentos en su fase de comercialización.
Así mismo, con base en la información obtenida de los ensayos clínicos con respecto a la seguridad y eficacia (relación riesgo/beneficio), se otorga una autorización de uso por parte de la Autoridad Sanitaria, para la indicación estudiada. Esta autorización se otorga a través de un Registro Sanitario, el cual tiene una vigencia limitada, que en Colombia se establece para un periodo de 5 años. Pasado este tiempo, la Autoridad Sanitaria evalúa el comportamiento de la eficacia y seguridad del medicamento, con base en lo cual decide la renovación del registro. Esta información la obtiene a través de los reportes de eventos adversos allegados al programa nacional de farmacovigilancia.
En este sentido, la farmacovigilancia se constituye en la estrategia a través de la cual se continúa evaluando la seguridad de los medicamentos en su etapa de comercialización, lo cual es menester de todos los segmentos de población que utilizan estos insumos en salud, desde los fabricantes y autoridades sanitarias como a los pacientes, sus cuidadores, profesionales sanitarios, comunidades científicas, académicas y población civil.
